Agenda del Curso de Tratamiento
Duración de la infusión1,2
El teplizumab se administra en un curso consecutivo de 14 días. Se administra por vía IV durante 30 minutos, pero se debe informar a los pacientes que planifiquen al menos 2 horas. El tiempo incluye la evaluación previa al tratamiento, el lavado del acceso IV y la preparación del medicamento. El tiempo real de infusión es de 60 minutos, incluyendo la administración de terapias de premedicación (30 minutos) y la infusión de teplizumab (30 minutos), con observación posterior al tratamiento que típicamente dura 60 minutos. Sin embargo, se requiere tiempo adicional los días que se realizan pruebas de laboratorio.
Se recomienda que se complete el tratamiento completo de 14 días sin interrupción. Sin embargo, si se omite una dosis, es importante administrarla lo antes posible. No se debe administrar más de una dosis en 24 horas; por lo tanto, no se debe duplicar la dosis si se omite una.
También se recomienda que el primer día de tratamiento sea un lunes, para garantizar que las escaladas de dosis que ocurren durante los días 1 al 5 se realicen durante la semana, cuando el personal está más disponible en caso de cualquier problema o inquietud.
Esquema de dosificación
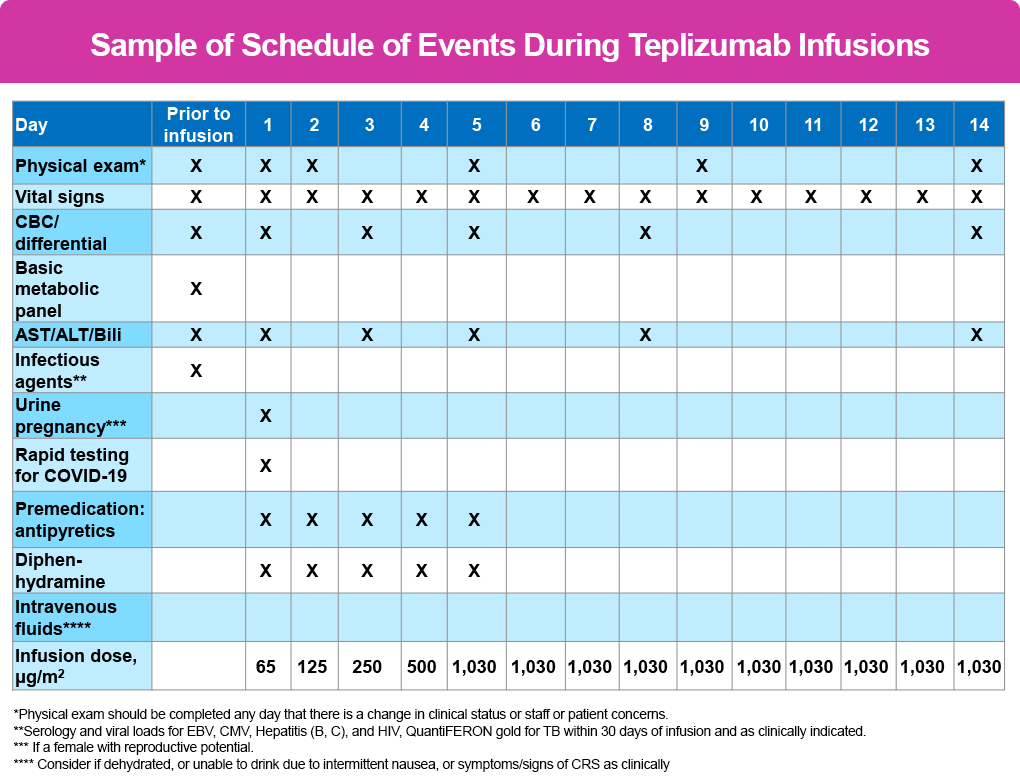
- Día 1: 65 mcg/m²
- Día 2: 125 mcg/m²
- Día 3: 250 mcg/m²
- Día 4: 500 mcg/m²
- Días 5 a 14: 1030 mcg/m²
Pedido de suministros para el hogar
- Cuidado de la línea de acceso vascular
- Kits de apósitos
- Kit de reacción adversa a medicamentos (ver sección de Monitoreo de EA)
- Bomba de infusión
- Soporte IV con abrazadera de poste
Preparación de la infusión (técnica aséptica)1,2
- El teplizumab se suministra como una solución transparente e incolora en un vial de dosis única de 2 mg/2 mL (se necesitan 2 viales para los días 5 a 14)
- Debe mantenerse refrigerado a 36 °F a 46 °F (2 °C a 8 °C) – no congelar
- Debe mantenerse en su envase original para protegerlo de la luz
- Debe almacenarse en posición vertical
- No agitar el vial
La dosis adecuada (ver esquema de dosificación) debe diluirse en 25 mL de solución salina normal (NS) y la infusión DEBE completarse dentro de las 4 horas posteriores a la dilución. Una vez diluido, debe almacenarse a temperatura ambiente (59 °F a 86 °F o 15 °C a 30 °C). Si no se administra dentro de las 4 horas posteriores a la preparación, debe desecharse.
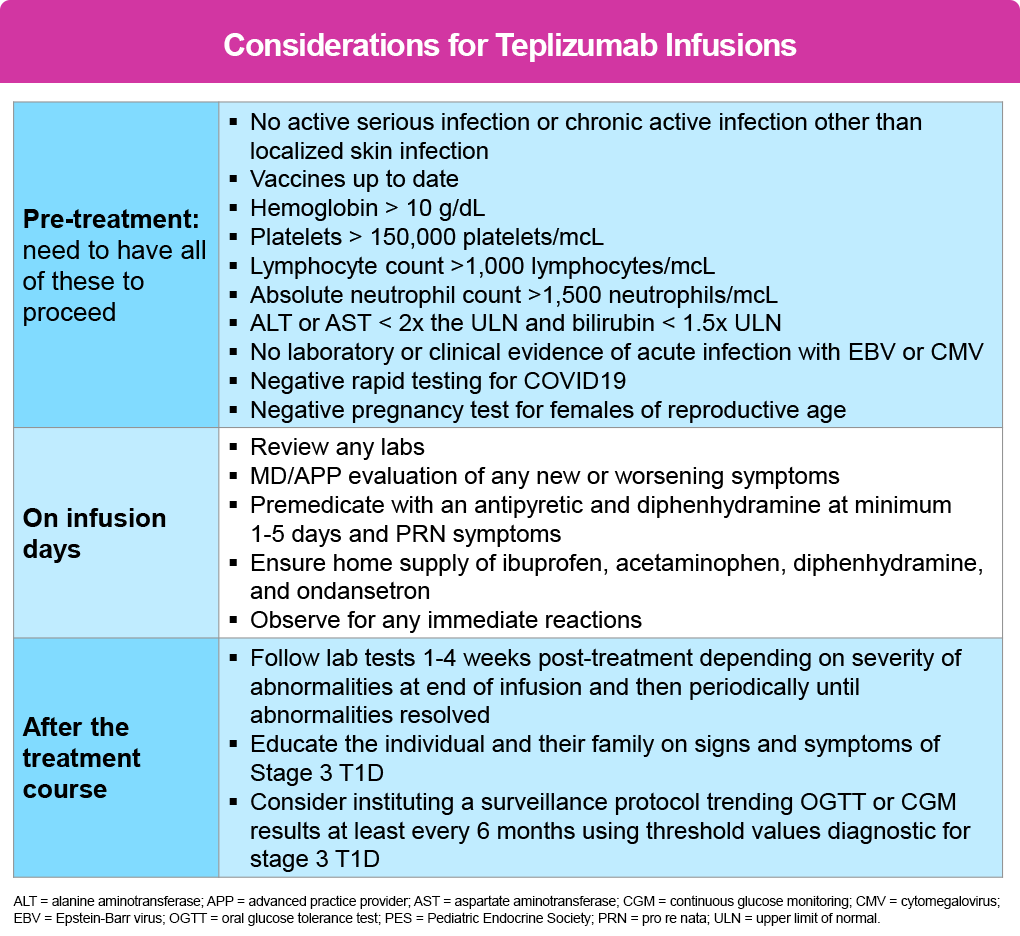
Evaluación general y estudios de laboratorio (Recomendaciones mínimas)1,2
- Examen físico – días 1, 2, 5, 9, 14 – y en cualquier momento si hay un cambio en el estado clínico
- Signos vitales – antes, cada 15 minutos durante, y al final de 1 hora de observación posterior a cada infusión
CBC, AST/ALT/Bili – se verifican antes de la terapia de infusión y nuevamente en los días 1, 3, 5, 8 y 14. Muchos médicos solicitan análisis después de la infusión del día anterior para determinar el curso de acción del día siguiente (por ejemplo, los análisis realizados después de la infusión del día 3 determinarán si se administra o se suspende el tratamiento en el día 4).
Premedicación1,2
La premedicación no solo se recomienda, sino que forma parte de las instrucciones de la etiqueta de la FDA y debe administrarse en los días 1 a 5, y luego según sea necesario en los días 6 a 14.
El propósito de la premedicación es reducir el riesgo de síndrome de liberación de citoquinas (CRS) severo, que típicamente emerge durante los primeros 5 días de tratamiento cuando se escalan las dosis de teplizumab. Sin embargo, los signos y síntomas pueden aparecer en cualquier momento durante la ventana de tratamiento de 14 días, así como hasta 28 días después de la última infusión.
Como premedicación, se administra al paciente 30 minutos antes de iniciar la infusión de teplizumab un AINE (por ejemplo, ibuprofeno) o paracetamol (APAP), más un antihistamínico (por ejemplo, difenhidramina), y opcionalmente un antiemético (por ejemplo, ondansetrón).
Algunos médicos han observado que el antiemético resulta más útil más tarde en el día, por lo que es importante asegurarse de que el paciente disponga de un suministro en casa.
Además, varios médicos han encontrado que el uso de un antihistamínico de acción prolongada (por ejemplo, loratadina, etc.) puede ser tan efectivo como la difenhidramina, pero sin la somnolencia asociada.
Dado que se monitorean las enzimas hepáticas elevadas como componente del CRS, muchos médicos han optado por utilizar un AINE en lugar de APAP para reducir el impacto en el hígado.
De todas las recomendaciones previas al tratamiento, una hidratación adecuada es, sin duda, la más importante para reducir la probabilidad de eventos adversos (EA). Esto debería lograrse con hidratación oral, pero si el paciente no puede consumir líquidos adecuados debido a náuseas, se pueden administrar líquidos intravenosos (por ejemplo, de 500 mL a 1 L de solución salina normal) como parte del pretratamiento o postratamiento.
Las siguientes tablas describen la agenda/programa de eventos recomendado por la PES² y es aplicable a todos los pacientes, independientemente de la edad:
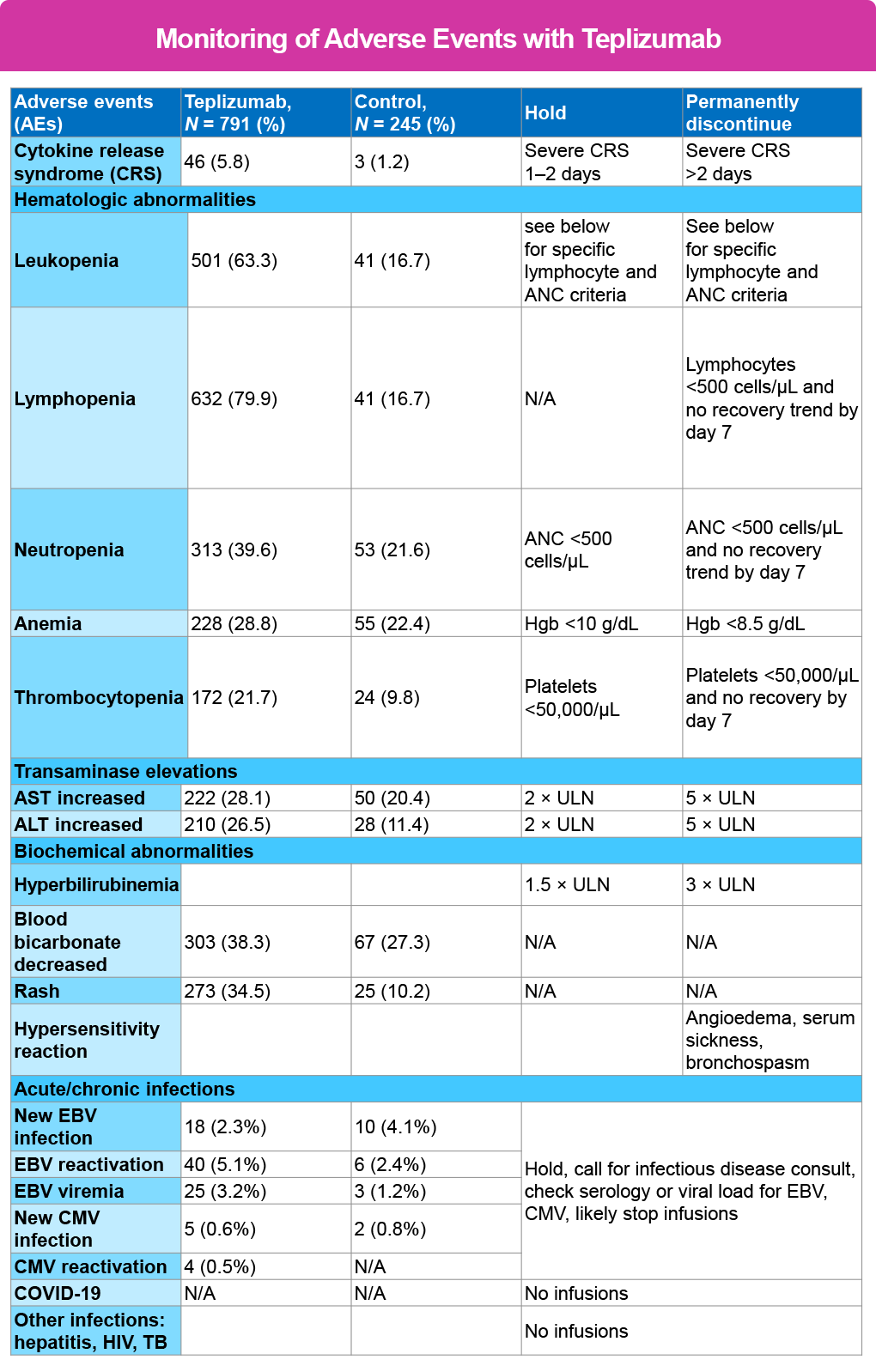
Monitoreo de EA1,2
La mayoría de las reacciones reportadas han sido leves y se han podido mitigar mediante el uso de antipiréticos, analgésicos, antieméticos y antihistamínicos. Por lo tanto, cualquier síntoma que experimente el paciente y que no responda a estos tratamientos requerirá atención médica de emergencia inmediata.
La fiebre es el signo distintivo del CRS, y puede verse atenuada por el uso de AINE o APAP. Si la fiebre ocurre de forma aislada (sin otros signos y síntomas de CRS), se deben considerar otras enfermedades agudas o infecciones como la causa, especialmente si el paciente tiene un catéter central en uso.
Las reacciones más comúnmente reportadas han incluido linfopenia, elevación de enzimas hepáticas asociadas (LAE), cefalea y erupción cutánea. Se ha observado que la linfopenia alcanza su punto más bajo alrededor del día 5 de la terapia y luego mejora, con retorno a los niveles basales hacia el día 42, reportándose en varios casos la normalización antes de completar la terapia.
Se instruye a los pacientes para que tomen las máximas precauciones a fin de evitar la exposición a personas enfermas durante las 2 semanas previas al inicio de la terapia y hasta la normalización del recuento de linfocitos. Esto puede incluir el uso de mascarilla al asistir a la escuela, trabajo, etc.
La erupción cutánea se ha descrito como lesiones maculopapulares, altamente pruriginosas, que pueden aparecer en cualquier parte del cuerpo. Las manos y los pies son las zonas más afectadas, aunque también se han reportado lesiones en el cuero cabelludo y en otras áreas. Aunque resultan molestas para el paciente, todas las erupciones se han resuelto de manera espontánea al finalizar el tratamiento con teplizumab y sin requerir tratamiento específico. Es importante instruir al paciente para que evite rascarse, con el fin de reducir el riesgo de infecciones secundarias. Los hidratantes, los esteroides tópicos de baja dosis, los antihistamínicos orales adicionales y los antihistamínicos tópicos pueden proporcionar cierto alivio.
En el caso de terapias administradas en el domicilio del paciente, se recomienda encarecidamente que el protocolo de prescripción incluya un kit de anafilaxia para el hogar que contenga: epinefrina 1 mg/mL (dos viales), administrada por vía intramuscular (IM) según la guía de dosificación basada en el peso; difenhidramina 50 mg/mL, vial de 2 mL (dos viales), administrada en bolo intravenoso (IV push) a razón de 25-50 mg; jeringas, agujas y soluciones de enjuague de solución salina normal (NS) al 0,9% (10 mL) para la administración.
Debe existir una orden permanente que indique que lo anterior debe ser utilizado por el profesional de salud en el domicilio del paciente en caso de que ocurra una reacción adversa/anafilaxia, al mismo tiempo que se activa el servicio de emergencias médicas EMS.
La siguiente tabla proporciona orientación sobre cuándo y por cuánto tiempo se debe suspender o interrumpir el tratamiento.²
Referencias
- Tzield® (teplizumab-mzwv). Información de prescripción. Provention Bio, Inc; 2023. https://products.sanofi.us/tzield/tzield.pdf
- Mehta S, Ryebets-Lienhard A, Patel N, et al. Declaración de la Sociedad de Endocrinología Pediátrica sobre consideraciones para el uso de teplizumab (TzieldTM) en la práctica clínica. Horm Res Paediatr. 2024, 30 de abril: 1-12.